Теплоизолированная система – Большая Энциклопедия Нефти и Газа, статья, страница 3
Теплоизолированная система
Cтраница 3
Как показала практика расчетов, подтвержденных данными экспериментов, время счета различных режимов охлаждения трубопроводов на ЭВМ-1022 по программе Расчет нагрева и охлаждения трубопроводных систем составляет 10 – 15 мин, по программе Расчет гидродинамического режима трубопроводных систем – 3 мин, по программе Расчет неустановившихся неизотермических режимов трубопроводных систем – 20 – 30 мин, по программе Расчет нестационарного температурного поля в теплоизолированном трубопроводе с движущейся средой – 50 – 90 мин для собственно трубопровода и 110 – 130 мин для процессов теплообмена в изоляции, по программе Расчет сопряженной задачи динамики теплообмена в теплоизолированных системах – 180 – 320 мин, что на порядок больше, чем по программам гл. [32]
Термодинамическую систему, которая не может обмениваться теплом с окружающей средой, называют теплоизолированной или адиабатически изолированной системой. Примером
Термодинамическую систему, которая не может обмениваться теплом с окружающей средой, называют теплоизолированной или адиабатически изолированной системой. Примером теплоизолированной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, делающей невозможным теплообмен между заключенным в сосуд газом и окружающими телами. Такую идеальную тепловую изоляцию или теплоизолирующую оболочку называют адиабатической оболочкой. [34]
Система, окруженная так называемой адиабатной оболочкой, исключающей теплообмен с окружающей средой, называется теплоизолированной, или адиабатной, системой. Примером теплоизолированной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между газом и окружающей средой. [35]Если dQ 0, то система теплоизолирована. Квазистатический процесс теплоизолированной системы называют адиабатическим Из (19.13) видно, что при адиабатическом процессе энтропия тела остается неизменной. [36]
Мы видим, что эта производная отрицательна, т.е. Д уменьшается с увеличением S. Но энтропия теплоизолированной системы не может убывать. Поэтому наибольшее возможное Д будет достигнуто, если S останется в течение всего процесса неизменной. [37]
Тепловое излучение называется стационарным, если температура излучающего тела остается неизменной за счет непрерывного его нагревания. Стационарное тепловое излучение, происходящее внутри теплоизолированной системы тел, могущих обмениваться энергией лишь путем испускания и поглощения электромагнитных волн, называется равновесным тепловым излучением. При равновесном тепловом излучении энергия электромагнитных волн, излучаемых в единицу времени каждым телом системы, равна энергии волн, поглощаемых этим телом за то же время. Примером равновесного теплового излучения является излучение, устанавливающееся внутри замкнутой полости с излучающей оболочкой, окруженной абсолютно теплонепроницаемой изоляцией. [39]
Испускательная и поглощательная способности непрозрачного тела взаимосвязаны. Для отыскания этой связи рассмотрим теплоизолированную систему, состоящую из двух бесконечно длинных пластин а и b ( рис. 35.2), которые могут обмениваться энергией в форме теплоты только друг с другом, так как их внешние поверхности покрыты идеальной тепловой изоляцией. Если в этой системе установилось термодинамическое равновесие, то температуры обеих пластин одинаковы и равны Т, а излучение пластин – равновесное. [40]
Испускательная и поглощательная способности непрозрачного тела взаимосвязаны. Для отыскания этой связи рассмотрим
Испускательная и поглощательная способности непрозрачного тела взаимосвязаны. Для отыскания этой связи рассмотрим теплоизолированную систему, состоящую из двух беско -, нечно длинных пластин а и b ( рис. 10.2), которые я могут обмениваться энергией в форме теплоты только друг с другом, так как их внешние поверхности покрыты идеальной тепловой изоляцией. [42]
Выражения (2.28) и (2.29) переходят в равенство, если все процессы в системе протекают обратимо. То есть обратимые процессы в теплоизолированной системе происходят без изменения энтропии и потому называются изоэнтропическими процессами. [43]
Стефана – Волъцмапа закон, Планка закон излучения, Кирхгофа закон излучения, к-рые строго выполняются лишь для равновесного излучения. Равновесное тепловое излучение можно получить в замкнутой теплоизолированной системе излучающих тел, темп-ры к-рых равны. В этих условиях, согласно второму закону термодинамики, результирующий перенос тепла между телами отсутствует и соотношение между энергией излучения и внутренней энергией нагретых, тел не изменяется. В условиях неравновесного излучения, когда темп-ры излучающих тел различны и существует результирующий поток лучистой энергии, применение законов равновесного излучения возможно лишь при предположении о локальном термодшюмич. [45]
Страницы: 1 2 3 4
www.ngpedia.ru
изолированные, закрытые, открытые, гомогенные, гетерогенные
При изложении основных положений термодинамики пользуются набором определенных строго сформулированных понятий, начальное из которых – понятие термодинамической системы, являющейся объектом исследования в термодинамике.
Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела. Внешнюю среду или внешний мир представляет собой то, что находится вне оболочки системы.
Выделение термодинамической системы из окружающей среды или внешнего мира весьма относительно. Менее сложные системы, являясь самостоятельной структурной единицей, могут одновременно быть составными частями более сложных систем, в этом случае они часто называются подсистемами. Это можно проиллюстрировать на примере биологических систем, расположенных в порядке усложнения в следующем иерархическом ряду: органелла – клетка – ткань – орган – система органов – организм – популяция – биоценоз – биосфера.Границаилиповерхность раздела термодинамической системыможет представлять собой какую-нибудь реальную оболочку. Например, стенки сосуда, в котором осуществляется химическая реакция, мембрана животной и растительной клетки. Но чаще всего эта граница бывает воображаемой или условной и наделенной заранее заданными свойствами.Так, она может быть проницаемой или нетеплопроводной, механически жесткой или нежесткой, т.е. способной изменять свои размеры.
В зависимости от свойств поверхности раздела, термодинамические системы делятся, в первую очередь, на изолированные,закрытыеиоткрытые(рис. 2).
Изолированные системыне могут обмениваться с окружающей средой ни веществом, ни энергией.Закрытые системыобмениваются с внешним миром только энергией, аоткрытые– и веществом, и энергией.
Рис. 2. Примеры закрытой (а), открытой (б) и изолированной (в) систем
Следует подчеркнуть, что реальные системы никогда не бывают абсолютно изолированными, они лишь в той или иной степени приближаются к данному понятию, но полностью с ним не совпадают.
Некоторые системы можно поместить (реально или мысленно) в условия, которые делают их искусственно изолированными. Примером такой изолированной системы можно считать химическую реакцию, идущую в термостате. Изменение энергии в ходе протекания реакции компенсируется включением или выключением нагревателя, в результате чего общая энергия системы будет оставаться постоянной.
Закрытые и открытые системы могут существовать реально, причем наиболее распространенными системами в природе являются открытые системы. К их числу относятся все биологические системы: животные и растительные клетки, организмы, человек и т.д. Примером закрытой системы является любой герметический сосуд, в котором протекает та или иная химическая реакция.
Термодинамика открытых систем описывается с помощью сложного математического аппарата, который до настоящего времени полностью не разработан. Закрытые и особенно изолированные системы имеют более простое математическое описание, и полученные на их основе результаты часто успешно используются для прогнозирования протекания аналогичных физико-химических процессов в открытых системах.
В зависимости от своего состава термодинамические системы подразделяются на простыеилиоднокомпонентныеисложныеилимногокомпонентные (рис. 3).
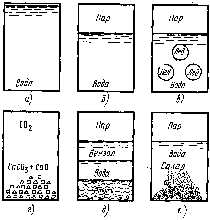
Рис. 3. Различные виды термодинамических систем: а– однофазная гомогенная система, состоящая из воды;б– двухфазная однокомпонентная система «вода – пар»;в– трехфазная однокомпонентная система «лед – вода – пар»;г– трехфазная многокомпонентная система «СаСО3– СаО – СО2»;д– четырехфазная многокомпонентная система «ртуть – вода – бензол – пар»;е– неустановившаяся система с неопределенным числом фаз
Простые системысостоят только из одного вещества,сложные системывключают в себя несколько различных химических веществ.
Если между отдельными частями системы не существует физических, т.е. реальных границ раздела, то такие системы называются гомогенными (однородными). Свойства данных систем, находящихся в состоянии равновесия, одинаковы во всех их точках.
Существуют также системы, между отдельными частями которых имеются границы раздела. При переходе через них многие свойства меняются скачкообразно. Такие системы называются гетерогенными.
Совокупность всех однородных по составу и физико-химическим свойствам частей гетерогенной системы, отделенной четкой и определенной поверхностью раздела, называется фазой. Гомогенные системы всегда состоят из одной фазы, а гетерогенные являются многофазными: двухфазными, трехфазными и т.д. Очень часто вещества, находящиеся в различных фазах, отличаются друг от друга агрегатными состояниями (рис. 3). Но могут быть и гетерогенные системы, в которых разные фазы находятся в одном и том же агрегатном состоянии. Например, три несмешивающиеся между собой жидкости: бензол, вода и ртуть (рис. 3).
И гомогенные, и гетерогенные системы могут быть однокомпонентными и многокомпонентными. Однокомпонентной гомогенной системой является любое жидкое или газообразное вещество, помещенное в тот или иной сосуд (герметический или открытый).
Трехфазной гетерогенной системой, состоящей из одного химического вещества, является, например, сосуд, частично заполненный водой, в которой плавают кусочки льда, а над поверхностью жидкости находятся водяные пары.
Многокомпонентной гомогенной системой является смесь из нескольких газов (например, воздух), истинный раствор вещества (или смеси веществ) в воде либо в каком-нибудь другом растворителе.
studfiles.net
Изолированная система в термодинамике: определение, особенности и примеры
В термодинамике есть несколько видов систем: изолированная и неизолированная. То, где они встречаются, когда применяются, показывает, насколько они полезными могут быть и как за ними ухаживать. В противном случае, если такие системы оказываются вредными для работы человека, – как от них избавиться.
Что это такое?
Изолированная система – это абсолютно любое скопление атомов и молекул (вещь, планета, человеческое тело), которое сохраняет в себе энергию всего вещества. Такая система полностью изолирована от внешнего мира, её ещё называют замкнутой.
Суть изолированной системы сводится к тому, что она при всём своём желании не будет делиться теплотой, не транжирит энергию, вещество у неё отнимать придётся силой. Для примера можно посмотреть на аквариум. Внутри него происходят процессы: дохнут рыбки, портится вода, разрушаются ракушки. Но с внешней средой аквариум не контактирует.
Ещё одним примером изолированной системы является утюг – энергию сам не потратит, веществами не поделится. Такое явление наблюдается у танковых двигателей, Солнечной системы – у всего, что не делится энергией с другими.

К замкнутым изолированным системам нельзя отнести автомобиль – он передвигается с определённой скорость сам! Также не относятся чайники, растения, живые организмы – они делятся с окружающим миром веществами. Живые организмы выделяют продукты обмена, растения – кислород, чайник – пар при закипании.
Интересный факт: замкнутой называют такую систему, где сумма производимых сил и работы равна нулю, а изолированной – где тела просто действуют отдельно от других систем. При этом изолированная система не всегда замкнутая, но замкнутая система обязательно будет изолированной.
В движениях – ловушка
Есть один нюанс: двигаться им самим нельзя, а вот если их кто-то передвигает, то правило не нарушается. Так, если взять изолированную систему и кинуть её с высоты, случайно уронить, сбросить с парашюта – неважно, изолированной она быть не перестанет. Если конечно не разбить её при таких действиях – та же бутылка с водой, скинутая с высоты, выпустит наружу всю воду – поделится с другими системами веществом – что означает, что система будет уже не замкнутой.

Под такое описание подходят пистолет и пуля – не действует без пальца на курке, тяжёлое тело и Земля – ничего не происходит, если не толкнуть тело на почву.
Теплоту учитывать тоже надо
Изолированная система в термодинамике – это макротело, которое вообще ни разу ничем не делится: энергия, вещество и тепло не выходят за пределы системы. Как пример – термос. Он сохраняет градус налитого в него чая, напитком без вмешательства человека насильно (открыть и вылить самому) не поделится, и энергию никуда не тратит.
Причем изолированная система всегда стремится прийти в термодинамическое равновесие, и нужен кто-то третий, чтобы её вывели из этого состояния. То есть, если приводить пример того же термоса, то при длительном его нахождении в окружающей среде чай все равно остынет. Поэтому нужен человек, который опять его зальёт горячим чаем, и система вновь будет термодинамически изолированной.
Зачем оно надо?
Понятие изолированной системы охватывает многие механизмы, системы и экосистемы. Человеку понимание того, как они устроены, нужно для того, чтобы правильно за ними ухаживать. Если это аквариум, то перед тем, чтобы в него полезть с руками и ногами, пытаясь почистить, нужно сначала посмотреть, как сделать всё так, чтобы не нарушить её. Если это механизмы или оборудование – как ими пользоваться, чтобы потом не было мучительно больно их чинить.

При этом, если брать в глобальных масштабах, пустыня – тоже изолированная система: внутри неё происходят определённые механизмы жизнедеятельности, которые за её пределы не выходят. Леса, степи, вулканы, а также атмосфера служат относительно изолированными экосистемами. Люди, не понимая, как они работают, порой сами не осознают, беды какого масштаба они создают.
Есть ещё одно «но». Изолированная система никогда не будет существовать абсолютно отдельно от других систем. Но это понятие существует. Оно удобно для того, чтобы проводить подсчеты в математике, термодинамике, химии и физике. Всю энергию и вещество, что выделяет изолированная система, принимают за ноль и оперируют теми числами, которые необходимы в данный момент.
Изолируем неизолируемое!
Даже открытая система может стать изолированной, если её отгородить чем-то от окружающей среды. В роли перегородки выступает адиабатическая система, которая служит оболочкой для открытой системы, делая её замкнутой. Ее можно сравнить с фольгой, которой обматывают предмет, стремясь защитить его от солнечных лучей.
Если разглядывать в более широком смысле, то примером может служить атмосфера для Земли – она защищает планету от космического влияния и служит оболочкой, которая даёт нам жизнь.

Существует закон сохранения импульса для замкнутой изолированной системы: Сумма импульсов в замкнутой системе остается постоянной, как бы тела не взаимодействовали между собой внутри системы. И это правильно: хоть сила импульсов может меняться со временем, обстоятельствами, возможностями, все равно их сумма будет оставаться постоянной.
В конце – жирная точка…
Таким образом, вывод напрашивается такой:
- Изолированная система не зависит от окружающей среды, насколько это вообще возможно, производя внутри себя энергию, работу и вещество. Она останется постоянной, при этом стремясь к равновесию.
- Замкнутая изолированная система тоже будет не зависеть от условий окружающей среды, из себя ничего не выделять, но работа в ней будет суммарно равна нулю. То есть закон сохранения импульсов будет распространяться скорее на такую систему, чем на незамкнутую.
- Изолированная система в термодинамике не будет зависеть от теплоты окружающей среды. Этого состояния пытаются добиться строители, когда утепляют дома. Кстати, пенопласт легко может служить адиабатической оболочкой для дома, делая его изолированной системой.
- Изолированной системы не существует в принципе: всё с чем-то взаимодействует. Если закрыть аквариум, вода будет бедной на кислород, и рыбки будут дохнуть. Они в любом случае остаются в минусе.

Изолированные системы нужны науке для того, чтобы была чистота эксперимента – некоторыми величинами можно пренебречь. А в жизни – за ними нужен правильный уход и использование.
fb.ru
1Техническая термодинамика
Тема 1. Основные термодинамические понятия и законы
1.1.Предмет и метод технической термодинамики
Исторически термодинамика возникла как наука, изучающая переход теплоты в механическую работу, что диктовалось необходимостью дать теоретические основы работы тепловых машин.
Принцип построения термодинамики довольно прост. В основу построения технической термодинамики положены три экспериментальных закона и уравнение состояния: первый закон (первое начало термодинамики) — закон сохранения и превращения энергии; второй закон (второе начало термодинамики) указывает направление, по которому протекают естественные явления в природе; третий закон (третье начало термодинамики) утверждает, что абсолютный нуль температуры недостижим.
1.2.Термодинамическая система
Термодинамическая система— тело (совокупность тел), способное (способных) обмениваться с другими телами (между собой) энергией и веществом.
Термодинамическая система имеет границы, отделяющие ее от окружающей среды. Границы термодинамической системы могут быть как реальными (газ в резервуаре, граница раздела фаз), так и чисто условными в виде контрольной поверхности.
Термодинамическая система может энергетически взаимодействовать с окружающей средой и с другими системами, а также обмениваться с ними веществом. В зависимости от условий взаимодействия с другими системами различают изолированную, замкнутую, открытую и адиабатно изолированную термодинамические системы.
Термодинамическая система, которая не может обмениваться энергией и веществом с другими системами, называется изолированной. В такой системе отдельные части (подсистемы) могут взаимодействовать между собой. Термодинамическая система называется закрытой, если она не может обмениваться веществом с другими системами. Термодинамические системы, которые могут обмениваться веществом с другими системами, называются открытыми.
Термодинамическая система, которая не может обмениваться теплотой с другими системами (окружающей средой), называется теплоизолированной или адиабатно изолированной.
С окружающей средой термодинамическая система может энергетически взаимодействовать посредством передачи теплоты и производства работы.
По роли отдельных тел, входящих в термодинамическую систему, их делят на рабочие тела (РТ), источники теплоты (ИТ) и объекты работы (ОР).
Рабочими телами являются, как правило, газообразные вещества – газы и пары, которые способны значительно изменять свой объём при изменении внешних условий.
В тех состояниях, когда можно пренебречь влиянием сил взаимодействия между молекулами и объёмом самих молекул (сильно нагретый газ при небольших давлениях), газ называют идеальным. В противном случае газ называется реальным.
Рабочее тело в тепловой машине получает или отдаёт теплоту, взаимодействуя с более нагретыми или более холодными внешними телами. Такие тела носят название источников теплоты.
Тело, которое отдаёт теплоту рабочему телу и не изменяет свою температуру, называется верхним источником теплоты (ВИТ) или теплоотдатчиком. Тело, которое получает теплоту от рабочего тела и не изменяет свою температуру, называется нижним источником теплоты (НИТ) или теплоприёмником.
studfiles.net
«Основы химической термодинамики, химической кинетики и равновесия» Основы химической термодинамики
1. Что изучает химическая термодинамика:
1) скорости протекания химических превращений и механизмы этих превращений;
2) энергетические характеристики физических и химических процессов и способность химических систем выполнять полезную работу;
3) условия смещения химического равновесия;
4) влияние катализаторов на скорость биохимических процессов.
2. Открытой системой называют такую систему, которая:
1) не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
3. Закрытой системой называют такую систему, которая:
1) Не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
4. Изолированной системой называют такую систему, которая:
1) Не обменивается с окружающей средой ни веществом, ни энергией;
2) обменивается с окружающей средой и веществом, и энергией;
3) обменивается с окружающей средой энергией, но не обменивается веществом;
4) обменивается с окружающей средой веществом, но не обменивается энергией.
5. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле, помещен ной в термостат?
1) изолированной;
2) открытой;
3) закрытой;
4) стационарной.
6. К какому типу термодинамических систем принадлежит раствор, находящийся в запаянной ампуле?
1) Изолированной;
2) открытой;
3) закрытой;
4) стационарной.
7. К какому типу термодинамических систем принадлежит живая клетка?
1) Открытой;
2) закрытой;
3) изолированной;
4) равновесной.
8. Какие параметры термодинамической системы называют экстенсивными?
1) величина которых не зависит от числа частиц в системе;
2) величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния системы;
4) величина которых зависит от времени.
9. Какие параметры термодинамической системы называют интенсивными?
!) величина которых не зависит от числа частиц в системе;
2) Величина которых зависит от числа частиц в системе;
3) величина которых зависит от агрегатного состояния;
4) величина которых зависит от времени.
10. Функциями состояния термодинамической системы называют такие величины, которые:
1) зависят только от начального и конечного состояния системы;
2) зависят от пути процесса;
3) зависят только от начального состояния системы;
4) зависят только от конечного состояния системы.
11. Какие величины являются функциями состояния системы: а) внутренняя энергия; б) работа; в) теплота; г) энтальпия; д) энтропия.
1) а, г, д;
2)6;
3) все величины;
4) а, б, в, г.
12. Какие из следующих свойств являются интенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) а, б, г;
2)в,д,е;
3) б, в, г, е;
4) а, в, д.
13. Какие из следующих свойств являются экстенсивными: а) плотность; б) давление; в) масса; г) температура; д) энтальпия; е) объем?
1) в, д, е;
2) а, б, г;
3) б, в, г, е;
4) а, в, г.
14. Какие формы обмена энергией между системой и окружающей средой рассматривает термодинамика: а) теплота; б) работа; в) химическая; г) электрическая; д) механическая; е) ядерная и солнечная?
1)а,б;
2) в, г,д, е;
3) а, в, г, д, е;
4) а, в, г, д.
15. Процессы, протекающие при постоянной температуре, называются:
1) изобарическими;
2) изотермическими;
3) изохорическими;
4) адиабатическими.
16. Процессы, протекающие при постоянном объеме, называются:
studfiles.net
Система теплоизолированная – Энциклопедия по машиностроению XXL
Система, окруженная так называемой адиабатной оболочкой, исключающей теплообмен с окружающей средой, называется теплоизолированной, или адиабатной, системой. Примером теплоизолированной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, исключающей теплообмен между газом и окружающей средой. [c.15]Вода при 0° С и окружающая среда при 25°С образуют теплоизолированную систему, над которой производится работа А, увеличивающая степень ее неравновесное . Ввиду теплоизолированное системы А = Д( + EQ), где Я—внутренняя энергия воды, “о—окружающей среды. По первому закону термодинамики [c.119]
Если система не обменивается с окружающей средой энергией в форме теплоты, то такую систему называют теплоизолированной, или адиабатной. [c.11]
Как отмечалось выше, при заградительном охлаждении температура теплоизолированной стенки с небольшим коэффициентом теплопроводности практически совпадает с температурой пристеночного слоя газа. В этом случае объективной характеристикой качества системы заградительного охлаждения является ее эффективность, которая определяется выражением [c.482]
Если термодинамическая система не может обмениваться теплотой с другими системами (окружающей средой), то ее называют теплоизолированной или адиабатически изолированной системой. [c.10]
Если система теплоизолирована так, что теплообмен между системой и окружающей средой отсутствует, т е. dQ = 0, то в равновесных процессах, происходящих с такой системой при постоянном давлении, dI согласно уравнению (2.8) равно нулю, т. е. энтальпия теплоизолированной системы при изобарическом процессе сохраняет неизменное значение. [c.32]
Работа изменения объема Ь и полезная внешняя работа L, производимые теплоизолированной системой, или, что то же самое, работы Е и Е адиабатического процесса согласно выражению (2.8) составляют [c.32]
Система, которая не может обмениваться теплотой с другими системами (окружающей средой), называется теплоизолированной, или адиабатически изолированной системой. Оболочка, через которую тепловое взаимодействие невозможно, называется адиабатической. [c.9]
Если система теплоизолирована и теплообмен между системой и окружающей средой отсутствует, т. е. dQ = О, то в равновесных процессах, происходящих с такой системой при постоянном давлении, согласно уравнению (1.44) dl = О, т. е. в теплоизолированной системе при изобарическом процессе энтальпия не изменяется. [c.40]
Процедуре составления системы конечно-разностных уравнений локально-одномерной схемы целесообразно дать следующую физическую интерпретацию. На первом этапе область заменяется набором теплоизолированных между собой горизонтальных стержней (рис. 3.16, а), для каждого из которых методом баланса записывается соответствующая неявная конечно-разностная схема, учитывающая граничные условия задачи на вертикальных границах л = О и X 1 как граничные условия для торцов стержня. Подчеркнем, что при составлении уравнений ба .э.нса для нижнего и верхнего горизонтальных стержней их боковой теплообмен со средой учитывать не надо, т. е. адиабаты в направлении х проходят и по границам (/=0, у 1у. Поэтому система уравнений для первого и последнего го- [c.121]
Рассмотрим вопрос о существовании энтропии. Положение о существовании энтропии может быть сформулировано в виде принципа адиабатической недостижимости в окрестности точки, изображающей равновесное состояние термически однородной системы, существуют точки, которые не могут быть достигнуты при движении вдоль обратимой адиабаты. Поскольку через любую точку можно провести обратимую адиабату, то принцип недостижимости означает, что соседние адиабаты не пересекаются. Этот факт является следствием опыта, который можно легко представить себе, взяв в качестве термодинамической системы, например, 1 кг газа (идеального или реального), помещенного в теплоизолированный цилиндр с поршнем. Естественно предположить, что каждая адиабата из рассматриваемого семейства кривых характеризуется определенным значением особого параметра и это значение одинаково для каждой точки выбранной адиабаты. Таким особым параметром и является энтропия. [c.89]
При механически равновесном (обратимом) воздействии на адиабатно изолированную систему энтропия этой системы не изменяется. В случае неравновесного механического воздействия энтропия системы возрастает и тем больше, чем значительнее необратимость воздействия. В примере, приведенном в 9.1, где адиабатно изолированной системой является газ, заключенный в теплоизолированный цилиндр с подвижным поршнем, при необратимом сжатии энтропия газа возрастает, а при обратимом сжатии остается постоянной. [c.121]
Термодинамическую систему, которая не может обмениваться теплом с окружающей средой, называют теплоизолированной или адиабатически изолированной системой. Примером теплоизолированной системы является газ, находящийся в сосуде, стенки которого покрыты идеальной тепловой изоляцией, делающей невозможным теплообмен между заключенным в сосуде газом и окружающими телами. Такую идеальную теплоизолирующую оболочку называют адиабатической оболочкой. [c.9]
Закон Кирхгофа (1882 г.) устанавливает количественную связь между энергиями излучения и поглощения поверхностями серых и абсолютно черны Х тел. Этот закон можно получить из баланса лучистой-энергии для излучающей системы, состоящей из относительно большого замкнутого объема с теплоизолированными стенками и помещенных в него тел. Для каждого из этих тел в условиях термодинамического-равновесия энергия излучения равна поглощенной энергии [c.374]
При оболочках с системами снижения давления обеспечивается почти полная и быстрая конденсация пара, выделяемого при аварийной потере теплоносителя, для чего применяются гидрозатворы. Если оболочка оснащена гидрозатвором, то образующийся при аварии пар впускается в бак с водой и полностью конденсируется там. В ледовом конденсаторе (рис. 10.2) для конденсации аварийного пара используется лед, который находится в теплоизолированной кольцевой щели внутри цилиндрической защитной оболочки А. [c.117]
В теплоизолированной системе равновесное состояние характеризуется максимумом энтропии. [c.66]
Рассмотрим стационарный одномерный перенос теплоты и массы в системе, состоящей из парогазовой смеси, конденсата и твердой стенки. Такой процесс может быть реализован при конденсации пара на дне достаточно высокого сосуда, через днище которого отводится теплота Q и отсасывается масса жидкости / в количествах, равных поступающим через границу смесь — конденсат (рис. 2-6). Боковые стенки сосуда считаем теплоизолированными и непроницаемыми для массы. Поверхность конденсата плоская, толщина его слоя обозначена через б. [c.41]
Если начало координат разместить в плоскости теплоизолированного торца, а ось 2 цилиндрической системы координат совместить с осью цилиндра, то система уравнений процесса теплопереноса в стенке цилиндра имеет следующий вид [c.40]
Кузов полуприцепа – цистерна круглого сечения, теплоизолированная минеральным волокном, горизонтального расположения с небольшим наклоном назад, с системой налива и опорожнения емкости наливом, самотеком или битумным насосом, имеет систему подогрева материала в цистерне дизельными горелками через П-образные трубы горловина для наполнения емкости – с защитным сетчатым фильтром и лабиринтным вентиляционным клапаном для выравнивания давления. [c.258]
СТОЯНИЯ не являются равновесными. В частности, к таким процессам относятся все процессы выравнивания, т. е. процессы, в ходе которых замкнутая система, состоящая из двух или нескольких частей, находящихся в равновесном состоянии, но между которыми равновесие отсутствует, переходит в полностью равновесное состояние. Рассмотрим несколько примеров подобных процессов и покажем, что если процесс выравнивания происходит в теплоизолированной системе, дQ = О, то энтропия этой системы не остается постоянной, как было бы в случае равновесного адиабатического процесса, а возрастает. [c.113]
Рассмотрим прежде всего необратимый процесс в системе, которая не является теплоизолированной, а получает или отдает количество тепла дQ. Мы можем мысленно представить себе такой процесс как последовательность двух процессов — процесс перехода системы в равновесное состояние без подвода тепла, при котором энтропия возрастает dS > о, и последующий обратимый подвод или отвод тепла. [c.120]
Особый случай теплоизолированной системы. [c.179]
В случае теплоизолированной системы тепловые потоки через границу отсутствуют, так что второй член в выражении (12.20), соответствующий потоку тепла, равен нулю. Далее, если в такой изолированной системе Z совершается внутренне необратимый процесс, то Д5с положительно, а следовательно, ASz также положительно. Таким образом, если из начального устойчивого состояния в результате необратимого адиабатического процесса система переходит в конечное устойчивое состояние, то ее энтропия возрастет. Это утверждение рассматривалось в качестве так называемого принципа возрастания энтропии. Следует, однако, отметить, что справедливость этого утверждения была установлена нами путем логического развития изучаемого предмета, так что у нас нет нужды называть его принципом (или законом ). [c.179]
Связь 27, 30, 33 устранение 32 Сгорание полное 276, 279 продукты 300 Сжижение газов 245 Система 18 изолированная 23 определение 65 простая 18, 309 связанная 33, 34, 43 теплоизолированная 179 Скорость звука 328 Смеси воздушно-паровые 271 Сопротивление пассивное 37 Состав воздуха 277 равновесный 355 Состояние 19 допустимое 27, 28, 33 интенсивное 20 [c.478]
Рассмотрим теплоизолированный бесконечный цилиндр радиуса с цилиндрическим включением радиуса Я и длины 21, отличающимся от основного материала только температурным коэффициентом линейного расширения. Система подвергается мгновенному нагреву равномерно распределенными по всему ее объему источниками тепла мощности д. [c.213]
Рассмотрим свободную от внешней нагрузки систему, состоящую из п— прямолинейных слоев различной толщины и полупространства (рис. 6.8). Теплоизолированная по граничной поверхности 2= О система нагревается источниками тепла плотности Wf = qb z — d) os ox. [c.244]
Термический нейтрализатор представляет собой теплоизолированный объем со специальной организацией течения ОГ, устанавливаемый в выпускной системе двигателя и осуществляющий термическое доокисление токсичных компонентов за счет собственного тепла ОГ. Термическая нейтрализация не зависит от вида сжигаемого 76 [c.76]
О Это утверждение можно аргументировать и не входя в детали преобразования внутренней энергии в работу. Почему при Ш = АО неравновесная система нагреватель+холодильннк не может произвести работу Потому что ее внутренняя энергия в процессе установления равновесия остается неизменной все тепло от нагревателя переходит к холодильнику. Ясно поэтому, что работа будет тем больше, чем меньше будет энергия системы тело+среда в конце процесса установления за счет этого уменьшения энергии и совершается работа. Но конечное состояние этой теплоизолированной системы является равновесным и характеризуется определенным значением объема. Поэтому ее анергия будет тем меньше, чем меньше будет ее энтропия в силу определения (4.1) и ввиду положительности температуры производная (ди/дS)v > о, и это означает, что при неизменном объеме энергия растет с увеличением энтропии и уменьшается при ее уменьшении. Но энтропия теплоизолированной системы не может убывать. В лучШем случае, при обратимости процесса, она будет оставаться неизменной. Это и есть условие получения максимальной работы при этом конечная энергия системы будет минимально возможной. [c.113]
Максимальная полезная внешняя работа Lmax представляет собой работу, которую производит система над внешним теплоизолированным от системы объектом работы в обратимом процессе 1—2. Работу, которую должен затратить внешний источник работы, чтобы вернуть систему из состояния 2 в исходное состояние 1 в тех же самых условиях, т. е. работу обратного обрати- [c.96]
Систему называют изолированной, если она не обметива-ется энергией и веществом с другими системами, в протг вном случае систему называют неизолированной. Если система не может обмениваться теплотой с окружающей средой, ее считают адиабатной (или теплоизолированной). [c.30]
Работа изменения объема L и полезная внешняя работа L, производимые теплоизолированной системой, или, другими словами, работы L и L адиабатического процесса согласно выралсениям (1.42) и (1.44) [c.40]
Термодинамические системы бывают закрытые, если в них отсутствует обмен веществом через контрольную поверхность, и открытые, в которых обмен веществом с окружающей средой происходит через контрольную поверхность. Система, которая не обменивается энергией и веществом с окружаюнгей средой, называется изолированной. Если система не обменивается энергией в форме теплоты, то она называется адиабатной, или теплоизолированной. [c.9]
Равновесному состоянию системы при постоянных Sap соответствует мин. значение Э. Изменение Э. (ДЯ) равно кол-ву теплоты, к-рое сообщают системе или отводят от неё лри 1ЮСТ0ЯНН0М давлении, поэтому значения ДЯ характеризуют тепловые эффекты фазовых переходов (плавления, кипения и т. д.), хим. реакций и др. процессов, протекающих при постоянном давлении. В теплоизолированной системе при постоянном р Э. сохраняется, поэтому её называют иногда теплосодержанием или тепловой ф-цией (условие сохранения Э. лежит, в частности, в основе Джоуля— Томсона эффекта). Д. Н. Зубарев. [c.616]
Термодинамическая система может также обмениваться с окружающей средой энергией. Изолированной называется система, лишенная возможности обмениваться энергией в виде теплоты или работы с окружающей средой. Теплоизолированной, или адиабатной, системой называется система, которая не может обмениваться со средой теплотой, но способна обмениваться механической работой. Механичеси изолированная система не способна обмениваться с окружающей средой механической работой, но может обмениваться теплотой. [c.85]
Положим, что система является теплоизолированной, т. е. АЯ-ГоА5г = 0. Отметим, что, согласно данным табл.6.4, ОМП должно сопровождаться увеличением объема системы, Эу>0. Тогда превращение энергетически выгодно при условии [c.302]
Выравнивание давления. В теплоизолированном цилиндре имеется закрепленный поршень, разделяющий две порции газа с одинаковой температурой, но разными давлениями Р1 и Р2 (Р > Рг)- Поршень освобождается, и начинается процесс выравнивания давления. Реальный необратимый процесс является изоэнергетическим, так как система не совершает работы над внешними телами и не получает тепло извне. Для того чтобы иметь возможность пользоваться формулой dS = дQ / Т, заменим этот реальный процесс воображаемым изоэнергетическим равновесным процессом. Представим для этого, что на поршень справа действует внешняя сила, на бесконечно малую долю меньшая, чем Р — Р2 (на единицу площади поршня). Тогда сила давления на поршень будет почти уравновешена внешней силой и процесс расширения газа будет обратимым. Так как начальное и конечное состояния одинаковы для реального необратимого и воображаемого обратимого процессов (они лежат на одной и той же изоэнергетичес-кой линии), то изменения энтропии одинаковы для этих двух процессов. В ходе воображаемого процесса при расширении газа в левом отсеке на dV система совершает против внешней силы работу Р — [c.113]
В герметически закрывающуюся измерительную камеру, изготовленную из нержавеющей стали (рис. 25.33), помещается нагревательное устройство мощностью 1 кВ-А, состоящее из теплоизолированного каркаса, нагревателя, испытательного столика и системы электродов с выводами (контактными медными пластинами), помещенными на крышке нагревательного устройства. В корпус камеры встроен манипулятор, позволяющий осуществлять контакт измеряемых образцов с измерительной электрической схемой. Передвижной электрод, связанный с измерительным вводом посредством серебряной или платиновой проволоки, передвигается манипулятором к контактным пластинам, которые соединены посредствой неподвижных электродов с измеряемыми образцами. При определении сопротивления изоляции Яжт, высоковольтным электродом является испытательный столик, выполненный из нержавеющей стали, при определении С/пр испытательный столик заземляется, высокое напряжение подается на ввод. Для удобства и точности манипуляций в процессе измерений в крышке испытательной камеры предусмотрены осветительное и смотровое стекла. Перед измерениями камера герметично закрывается, производится откачка воздуха до остаточного давления 1 Па, затем после отключения насоса камера заполняется аргоном до избыточного давления 25 кПа. После этого баллон с газом отключается и в камере консервируется аргон под общим давлением 1,25 10 Па. Скорость и время нагревания, контроль температур те же, что при измерениях в вакууме. Сопротивление изоляции вводов при 20 °С должно быть не менее 10 Ом, при 600 С —не менее 10 Ом f/ p ввода при 600 “С не менее 6 кВ. [c.297]
mash-xxl.info
Термодинамические системы, состояния и характеристики
1. В термодинамике объектом рассмотрения всегда является система.
Термодинамическая система — любой объект природы, состоящий из достаточно большого количества частиц (не менее 1010 —1013) и отделенный реальной или воображаемой границей от окружающей среды.
2. Различают 3 типа термодинамических систем (табл. 1.1):
а) Изолированные системы — не могут обмениваться с окружающей средой ни энергией, ни массой. Примеры: изолированный термостат, Вселенная в целом. б) Закрытые системы — могут обмениваться с окружающей средой энергией, но не массой. Пример закрытой системы — совокупность молекул растворенного вещества. Внешней же средой здесь является все остальное, начиная с растворителя (если он не участвует в реакции). Поэтому в химической термодинамике наиболее часто рассматривают именно закрытые системы.
в) Открытые системы — это системы, которые могут обмениваться с окружающей средой и энергией, и массой. Здесь самый важный пример — живые объекты.
3. Какую бы систему мы ни взяли, она может быть в различных состояниях. А чтобы описать то или иное состояние, используют термодинамические характеристики (аi).
Эти характеристики можно классифицировать двумя способами.
а) Во-первых, их делят на экстенсивные и интенсивные.
I. Экстенсивные параметры зависят от количества вещества и складываются при сложении однородных компонентов:
а0 = ? аi . (1.1)
Примеры — объем (V), масса (т), количество вещества (п), энергия (Е), относящиеся ко всей системе или к отдельным ее частям.
II. Интенсивные характеристики не зависят от количества вещества и выравниваются при контакте систем или частей системы. Сюда относятся такие параметры, как температура (Т), давление (Р), плотность (?), концентрация (с).
б) Другое подразделение таково.
I. Одни характеристики можно рассматривать как основные, которые определяют состояние вещества. Их называют параметрами состояния. Обычно в качестве таковых берут следующие характеристики — Т, Р и п, т. е. температуру, давление и количество вещества.
II. Остальные характеристики зависят от этих трех параметров, а значит,.в целом от состояния системы. Поэтому их называют функциями состояния. Так, для идеального газа энергия определяется только температурой и количеством вещества, а объем — всеми тремя параметрами состояния.
а) Значение любой из них не зависит от способа достижения системой данного состояния, а зависит только от самого этого состояния.
б) Для некоторых состояний используются специальные термины. Так, часто вещества (системы) рассматривают при стандартных условиях:
Т = 25° (298 К), Р=1 атм (101,3 кПа), п = 1 моль. (1.3, а–в)
Соответственно, стандартное состояние вещества — это 1 моль чистого вещества при стандартных температуре и давлении в наиболее устойчивом агрегатном состоянии.
Как видно, к условиям (1.3, а—в) здесь добавляется еще условие о наиболее устойчивом агрегатном состоянии. Для одного вещества это газообразное состояние, для другого — жидкое, для третьего — твердое в наиболее распространенной аллотропной модификации.
в) И стандартные, и многие другие состояния являются равновесными. В равновесном состоянии параметры состояния не изменяются самопроизвольно со временем, и в системе отсутствуют потоки вещества и энергии.
г) Наконец, еще один важный частный случай состояний — это стационарные состояния. Здесь параметры состояния тоже постоянны, но в системе имеются потоки энергии и (или) вещества.
д) Все прочие состояния системы являются, по существу, переходными — либо к равновесному, либо к стационарному состоянию.
worldofscience.ru